Halmazállapot
Víz a természetben szilárd, cseppfolyós és légnemű halmazállapotban fordul elő.
Az anyagok nem töltik ki folytonosan a teret, hanem a legkisebb részeik (elemi anyagok esetén az atomok, vegyületeknél a molekulák) egymástól bizonyos távolságra helyezkednek el, és a hőmérséklettől függő mértékű rezgő mozgást végeznek.
A víznek, mint vegyületnek (H20) legkisebb része a molekula. A víz szilárd halmazállapotú, ha jég formájában van jelen. Ha a jég hőmérséklete emelkedik, a vízmolekulák rezgő mozgása fokozatosan gyorsabbá válik, végül egy meghatározott hőmérsékleten (olvadáspont) a molekulák elhelyezkedésének szabályos rendje felbomlik és rendezetlenné válik. Ezáltal a szilárd halmazállapotú anyag cseppfolyóssá lesz. Ebben az esetben az egymásra ható vonzóerő, a kohézió összetartja még a molekulákat, de egymáshoz képest eltolódhatnak. Ezzel magyarázható, hogy a folyadék felveszi annak az edénynek (tartálynak, csőnek) az alakját, amelyben tárolják.
A folyadék felszínén elhelyezkedő molekulák egy része mozgás közben a vonzóerő ellenére elszabadul, és a környező légnemű tér molekulái közé keveredik. Ez a jelenség a párolgás.
A hőmérséklet emelkedésének hatására a molekulák mozgási sebessége fokozódik, több molekula szabadul el, a párolgás tehát erőteljesebb lesz. Amikor a víz hőmérséklete természetes légköri nyomáson (760 torr) eléri a 100 °C-ot, megindul a forrás. Ez a jelenség azzal magyarázható, hogy a folyadék belsejében leszakadó molekulákból képződött gőzbuborékok feszültsége ennél a hőmérsékletnél már legyőzi a víz szintjén ható légnyomást, és a gőzbuborékok a víz felszínére törnek, majd eloszlanak a környező térben. A víz légnemű halmaz- állapotba került. A forrásban levő víz 100 °C hőmérsékletű marad a teljes mennyiség elpárolgásáig.
Zárt kazánokban, ahol a vízfelületre ható nyomás nagyobb a természetes légköri nyomásnál, a forrás — a nyomás mértékétől függően — 100 °C felett kezdődik, ezzel szemben magas hegységekben, ahol a légköri nyomás lényegesen kisebb, mint tengerszint közelében, nyitott edényben már 100 °C-nál kisebb hőmérsékleten is felforr a víz.
A gőz lehűlésekor a folyamat ellenkező, a lehűlt molekulák lassabban mozognak, közelebb kerülnek egymáshoz, a vonzóerő erősebben hat, a gőzből ennek következtében ismét cseppfolyós anyag keletkezik.
A víz lehűlésekor a molekulák mozgási sebessége tovább csökken és a fagyásponton olyan közel kerülnek egymáshoz, hogy ismét meghatározott szabályos rendben helyezkednek el. Mozgásuk is rendezetté válik és a folyadék szilárd halmazállapotú lesz, megfagy.
A víz fagyáspontja 0 °C, amely egyébként azonos az olvadásponttal. A víz fagyáspontja megváltozik, ha valamilyen anyagot oldunk benne. A tenger vize kb. —2,5 °C-on kezd fagyni, mert oldott sót tartalmaz. A fagyáspont a víz sótartalma szerint különböző.
A fagyás számottevő — kb. 1/11 rész — térfogatnövekedéssel jár. A jég fajsúlya 0 °C-on 0,917 kp/dm3. A zárt térben megfagyott víz a térfogatnövekedés következtében szétrepeszti az edény falát, és cső-, kazán- stb. repedést okoz. A nyomás fokozásával a víz fagyáspontja — más folyadékokkal ellentétben — süllyed. Erős mozgásban levő víz 0 °C hőmérséklet alatt sem fagy meg.
Fajsúly
A víz fajsúlya (y) a hőmérséklet hatására változik és -f4 CC hőmérsékleten éri el legnagyobb értékét. Egy liter +4 °C-os víz súlya természetes légköri nyomáson (760 torr) és a tengerszinten 1 kp. Ugyanezen légköri nyomás mellett azonban a víz fajsúlya a hőmérséklettől függően változik.
Könyvünk 1. kiadásától eltérően a súly, fajsúly és a nyomóerő jelölésére kg, kg/dm3, kg/cm2 helyett a kp (kilopond), kp/dm3 és kp/cm2 megjelöléseket használjuk. A változást a fizikai-technikai tudományok fejlődése tette szükségessé. A kg jelölés egyértelműen csak a tömeg egységre vonatkozhat, amely nem azonos a súllyal, fajsúllyal, nyomással (pl. azonos tömegű test az egyenlítő táján kb. 0,5 %-kal kisebb súlyú mint a sarkokon, de mint tudjuk, űrrepülés közben akár súlytalan is lehet).
Fajhő
A víz felmelegítéséhez szükséges hő mennyisége a felmelegítendő víz tömegétől és a melegítés mértékétől függ. Egy kp víznek 1 °C-kal való felmelegítéséhez 1 kcal melegmennyiség szükséges. Az a melegmennyiség, amely szükséges ahhoz, hogy valamely anyagból 1 kp-ot 1 °C-kal felmelegítsünk, az anyag fajhője. Az előzőekből következik, hogy a víz fajhője: 1.
Összenyomhatóság
A víz térfogata — mint minden folyadéké — igen nagy erőhatásra is csak igen kis mértékben változik, vagyis gyakorlatilag összenyomhatatlan. A víz tér. fogata 1 kp/cm2 nyomás hatására 1/50 milliomod részével csökken. A víz faj. térfogatán 1 kg tömegű víz térfogatát értjük [dm3/kp] mértékegységgel kifejezve.
Viszkozitás (nyúlósság)
Folyadékok áramlása közben a folyadékrétegek áramlási sebessége különböző. Az egymáshoz képest elcsúszó rétegek között mozgást gátló, súrlódás jellegű ellenállás keletkezik. Ezt az ellenállást okozó erőt nevezik viszkozitásnak. Törvényszerűségét Newton (ejtsd: Nyútn) állapította meg. Megkülönböztetünk abszolút (dinamikus) és kinematikai viszkozitást.
Az áramlástan a folyadék áramlás vizsgálatakor (pl. a vízvezetékek méretezésének elméleti alapjaihoz is) a kinematikai viszkozitást alkalmazza számításaihoz. A kinematikai viszkozitás egysége a stokes (ejtsd: sztoksz), jele St. Használatos ennek századrésze is, a centistokes, amelynek jele cSt.
Viszkozitás a hőmérséklet csökkenésével növekszik. Ez az oka pl. annak, hogy télen a talajszemcsék között lassabban áramlik a víz és ennek következtében a talajkutak vízhozama csökken.
A hajszálcsövesség (kapillaritás)
Kis átmérőjű csőben — hajszál-, vagy más néven kapilláris csőben — nem érvényesül teljes mértékben a közlekedőedények törvénye. Ha az üvegből készült hajszálcsövet higanyba mártjuk, a higany lejjebb süllyed a hajszálcsőben a külső higanyszintnél, ugyanezt a csövet vízbe mártva, a víz magasabbra emelkedik a környező vízszintnél.
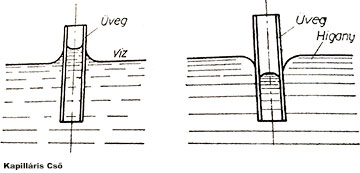
A jelenség megértéséhez tudni kell, hogy a cső falával érintkező folyadék molekuláira a nehézségi erőn kívül a folyadék-molekulák összetartó ereje a kohézió hat. Ezenkívül a cső falának molekulái is vonzóerőt gyakorolnak rá. Ez utóbbi tapadóerő az adhézió. Különböző folyadékok kohéziója, továbbá a csőfal és a folyadékok molekulái közt ható adhézió nem egyenlő mértékű (pl. a higany molekuláinak kohéziója az adhézióhoz képest nagy, a víznél ellenben kicsi). Ezzel magyarázható, hogy a vízből kiemelt üvegcső falához víz tapad. Ilyen esetben azt mondjuk, hogy a folyadék nedvesíti a szilárd testet. A higanymolekulák nem tapadnak az üveghez, mert a higanymolekulák között működő kohézió nagyobb, mint az üveg- és higanymolekulák közötti adhézió. Ilyen esetben a folyadék nem nedvesíti a szilárd testet.
A folyadék molekuláira három erő hat az edényfal közelében. 1. A súlya (g) lefelé, amelynek értéke kicsi; 2. a kohézió (k), a folyadék belseje felé és 3. az adhézió (a) az edényfal felé. A 4A és B ábrán ezeket az erőket nyilak jelzik. A nyilak hossza az erők nagyságával arányos. Nedvesítő folyadék esetében az adhézió nagyobb a kohéziónál, ezért a folyadék-felszín az edényfal közelében felgörbül (4A ábra). Nem nedvesítő folyadék esetében a kohézióhoz képest az adhézió kicsi, ezért az eredő a folyadék belseje felé mutat (4B ábra), és a folyadékfelszín az edényfal közelében lehajlik.
A hajszálcsövesség a természetben állandó jelenség, ezen alapszik többek között a növények nedvfelszívó képessége, valamint a talaj pórusaiban a nedvesség felhúzódása.
Az épületek falazatai is hajszálcsöves szerkezetűek, ezért a talajnedvesség felszívódása ellen a falakat szigetelni kell. Ha a falba szerelt vízvezetéki cső megreped, a fal (a nehézségi erő hatására) nedvesedése nemcsak a repedés helyétől lefelé, hanem a hajszálcsövesség hatására attól felfelé is mutatkozik.
